- 24 Ara 2023
- 188
- 0
- 16
Maddenin Halleri: Giriş
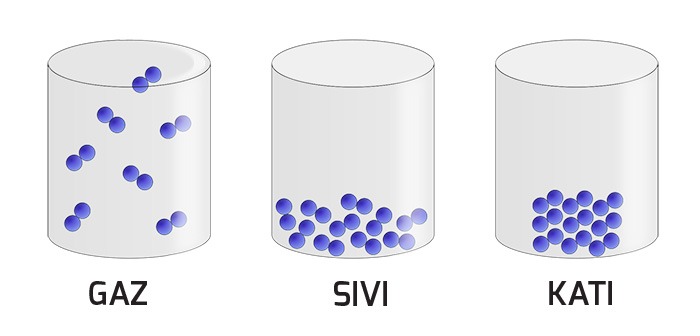
Uzayda yer kaplayan her şeye madde denir. Maddeler kütleye ve hacme sahiptir. Maddeler belirli basınç ve sıcaklıklarda maddenin 4 temel halinden birisinde bulunabilir; katı, sıvı, gaz ve plazma. Maddeleri oluşturan moleküllerin davranışları maddenin her halinde değişiktir.Maddenin 3 Hali: Katı – Sıvı – Gaz
Maddenin katı, sıvı ve gaz hallerini kıyaslamamız gerekirse; genellikle katı maddeler maddenin en düzenli ve moleküllerin birbirine belirli bir düzende sıkı bir şekilde bağlandığını gözlemleriz. Moleküller arası bağlar sıvılarda şiddetini azaltır ve bu yüzden sıvıların belirli bir şekli bulunmaz. Gazlarda ise bu bağlar yok denecek kadar güçsüzleşir.
Kısacası, moleküller arası bağların kuvveti maddenin katı, sıvı veya gaz halde bulunmasını etkiler. Bir maddenin molekülleri arasındaki bağ ne kadar güçlüyse, kaynama ve erime sıcaklıkları da o kadar yüksek olur.
Suyun Özel Durumu
Bir maddenin katı, sıvı ve gaz halindeki yoğunlukları karşılaştırıldığında genellikle katı fazının en yoğun, gaz fazının en düşük yoğunluk durumda olması beklenir. Ancak suda bu durum beklenilen şekilde gözlemlenmemektedir.Su, en yoğun haline sıvı fazdayken ve +4.0 °C (deniz seviyesinde) de geçer. Bu durum (katı hale geçen suyun) buzun sıvısı üzerinde yüzmesine sebep olur. Böylece göller veya denizler donduğu zaman suyun altındaki yaşam soğuktan etkilenmeden devam eder.
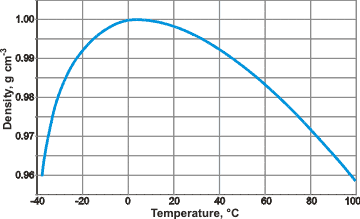
Suyun özktüle grafiği
Gaz Halinin Önemi ve Kimyasal Özellikleri
Gazlarda moleküller arası etkileşim çok az olduğu için sıkıştırılabilir. Bu sıkıştırılma özelliği sayesinde günlük hayatımızda kullandığımız deodorantları, evlerde kullandığımız tüpleri veya elektrik ürettiğimiz doğalgazı taşıyabilir ve istediğimiz zaman istediğimiz ölçüde kullanabiliriz.
Gazlar sıvılar içerisinde düşük sıcaklıklarda daha çok karışırlar. Bu nedenden dolayı içtiğimiz gazlı içeceklerin soğukluğuna bağlı olarak içindeki çözünen gaz miktarı değişkenlik gösterir. Eğer içeceğimiz daha soğuksa içerisinde daha çok gaz barındırır ve içeceğimiz daha lezzetli gelir. Ayrıca bazı gazlar klima gibi soğutucuların içerisinde kullanılır ve soğutma olayının gerçekleşmesini sağlar.
Gazların Tanımlayıcı Özellikleri
Kinetik teoriye göre gazlar, hızla hareket eden, molekülleri arasında büyük boşluklar olan ve birbirleriyle her oranda karışabilen moleküllerdir. Gazların sıkıştırılabilir yapısı günlük hayatımızda pek çok noktada kullanılır.
!Not: Gazların birbiri içerisinde tamamen homojen şekilde dağılması, yer çekimsiz ortamda mümkündür. Ancak lise seviyesinde yapılan çözümlerde yer çekimi etkisi denklemlere yansıtılmaz.
I) Gazların Tanımlayıcı Özellikleri
Gazlar tanımlanırken, basınç, hacim, gaz miktarı ve sıcaklık kavramları kullanılır.A) Basınç (P)
Gazlar, kütleleri ve hareketleri nedeniyle içinde bulundukları kaba çarparlar. Bu çarpmanın etkisiyle gaz basıncı oluşur. Bilimsel olarak basıncı P harfiyle gösteririz. Basıncın birimi N/m² (newton/metre kare) veya (Pa) pascaldır.
Atmosferde bulunan gazların uyguladığı basınca atmosfer basıncı denir. Atmosfer basıncı, deniz seviyesinden yükseklere çıkıldıkça azalır ve sıvıların kaynama noktasına etki eder (buhar basıncı ve kaynama noktası arasındaki ilişki).
Gazlarda Basıncın Ölçülmesi
Gazların basıncı, Torricelli tarafından geliştirilen barometre adlı aletlerle ölçülmektedir. Basınç birimi olarak Pa (Pascal) kullanılmaktadır, ancak kimyasal ölçümleri zorlaştırabilir, bu nedenle genellikle milimetre civa (mmHg) veya atmosfer (atm) basıncı daha yaygın olarak kullanılır. mmHg, Torricelli’nin adıyla ilişkilendirilerek Torr olarak da adlandırılır. Gazların basıncı, katı ve sıvı fazların basınç ölçümünden daha dolaylı olarak ölçülür. Barometreler, atmosfer basıncını civanın borudaki yükselme miktarına bağlı olarak ölçerler. Deniz seviyesinde yapılan bir atmosfer basıncı ölçüm deneyinde, atmosfer basıncı (normal şartlarda) 760 mmHg olarak bulunacaktır.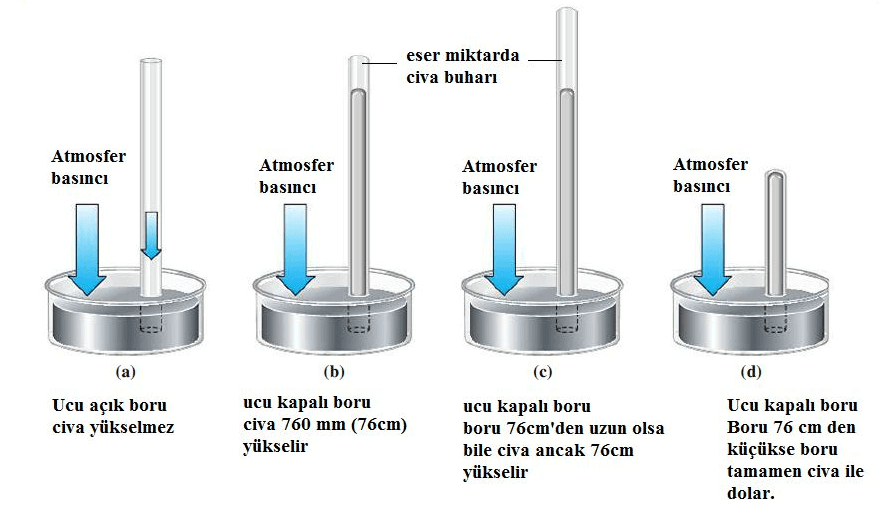
B) Hacim (V)
Gazlar, bulundukları kabın hacmini almaktadırlar ve bu özellikleri litre (L) birimiyle ölçülür. Hacmi litre cinsine çevirmek için 1 m³ = 1000 dm³ = 1000 L denklemini kullanabilirsiniz. Gazların hacimleri doğrudan ölçülememekle birlikte, sabit basınç ve sabit sıcaklık altında laboratuvar koşullarında deney düzenekleri kullanılarak hacim ölçümü gerçekleştirilebilir. Örneğin, 1 atm basınç altında ve 0°C derecede (normal şartlar altında) bulunan bir mol gaz, 22.4 L hacmi kaplar.
C) Gaz Miktarı (n – Mol)
Gazların miktarı kimyada yaygın olarak kullanılan mol sayısı kavramıyla ölçülür ve genellikle n harfi ile gösterilir. Örneğin, 12 gram saf karbon içeren bir gaz, 6.02 x 10^23 karbon atomu içerir ve bu sayı bir mola eşittir. Bu büyük sayıya “Avogadro Sayısı” denir ve genellikle NA ile simgelenir.
D) Sıcaklık (T – Kelvin)
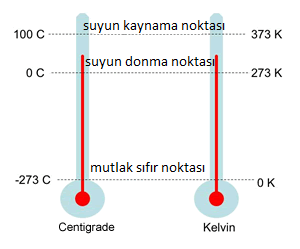
Bilimsel olarak sıcaklık, Kelvin sisteminde ölçülür ve “mutlak sıcaklık” olarak da adlandırılır. Bilimsel olarak 0 Kelvin derecesinde atomların ve moleküllerin bilinen tüm hareketleri durur. 0 Kelvin sıcaklığının altına düşmek teorik olarak mümkün değildir. Bu nedenle, Kelvin ölçümleri her zaman pozitif değerlere sahip olmalıdır. Celsius sıcaklığını Kelvin birimine dönüştürmek için aşağıdaki bağıntı kullanılır.
Kelvin (K) = Celcius (°C) + 273
Gaz Yasaları ve İdeal Gaz Denklemi
Gazlar arasında basınç, sıcaklık, hacim ve miktar gibi değişkenler arasında belirli ilişkiler bulunmaktadır. Bu özel ilişkilere “gaz yasaları” denir ve bu yasalara uyan gazlara da “ideal gaz” adı verilir. Gerçek durumda hiçbir gaz tam anlamıyla ideal değildir. Ancak, genellikle düşük basınç ve yüksek sıcaklık koşullarında, gazlar ideal gaz modeline yaklaşırlar.Gözlemsel Gaz Yasaları
Gaz yasaları, bilim insanlarının yürüttüğü çeşitli çalışmaların birleştirilmesiyle ortaya çıkmıştır. Bu çalışmalara “gözlemsel gaz çalışmaları” denir. Gözlemsel gaz çalışmalarında, gazların basınç (p), sıcaklık (T), hacim (V) ve mol sayısıA) Basınç – Hacim İlişkisi (Boyle Yasası)
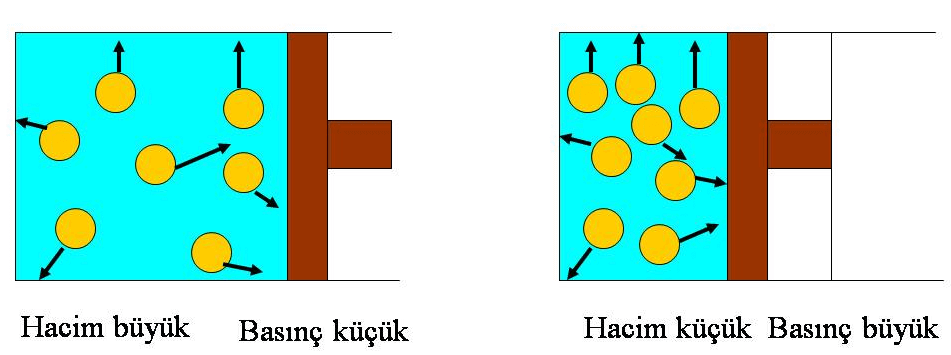
Gazların basınç-hacim ilişkisi 1660 yılında İngiliz bilim adamı Robert Boyle tarafından incelenmiştir. Boyle yapmış olduğu çalışmalar sonucunda sabit miktardaki ve sabit sıcaklıktaki bir gazın hacim azalmasına tepki olarak basıncının arttığını gözlemlemiştir.
Boyle Yasası: Sabit sıcaklıkta ve belirli bir miktar gazın hacmi, basıncıyla ters orantılıdır ve şu şekilde formülize edilir: P1V1= P2V2= k1 Denklemdeki;
- P1: Gazın ilk durumdaki basıncını
- P2: Gazın son durumdaki basıncını
- V1: Gazın ilk durumdaki hacmini
- V2: Gazın son durumdaki hacmini
- k1: Gazın sıcaklığına ve miktarına göre oluşturulan bir değişkeni temsil eder.
Sıcaklık – Hacim İlişkisi (Charles Yasası)
Gazın sıcaklık ve hacmi arasındaki matematiksel ilişki 1787 yılında İngiliz bilim adamı Charles tarafından bulunmuştur. Charles yapmış olduğu deneylerde sabit miktarlarda herhangi bir gazın sıcaklık değişimine aynı oranda tepki verdiğini gözlemlemiştir.Charles Yasası: Sabit basınçtaki belirli miktardaki gazın hacmi, mutlak sıcaklık değişimiyle orantılı olarak değişir ve şu şekilde formulüze edilir: V1T2= V2T1= k2 Denklemdeki;
- T1: Kelvin biriminden gazın ilk durumdaki sıcaklığını
- T2: Kelvin biriminden gazın son durumdaki sıcaklığını
- V1: Gazın ilk durumdaki hacmini
- V2: Gazın son durumdaki hacmini
- k2: Gazın basıncına ve miktarına göre oluşturulan bir değişkeni temsil eder.
Sıcaklık – Basınç İlişkisi (Gay – Lussac Yasası)
Gazların sıcaklık ve basınç ilişkisi 19. yy’ın başlarında Fransız bilim insanı Joseph Gay-Lussac tarafından bulunmuştur.Gay – Lussac Yasası: Sabit miktardaki ve hacimdeki bir gazın sıcaklığını arttırdığımızda gazın ortalama kinetik enerjisini (sıcaklığını) arttırdığımız için; gaz parçacıkları, gazın tutulduğu kabın duvarlarına daha çok çarpışır ve böylece basıncın artmasını sağlar. Yasa şu şekilde formulüze edilir: P1T2= P2T1= k3 Denklemdeki;
- T1: Kelvin biriminden gazın ilk durumdaki sıcaklığını
- T2: Kelvin biriminden gazın son durumdaki sıcaklığını
- P1: Gazın ilk durumdaki basıncı
- P2: Gazın son durumdaki basıncı
- k3: Gazın hacmine ve miktarına göre oluşturulan bir değişkeni temsil eder.
Hacim – Miktar İlişkisi (Avogadro Yasası)
Avogadro Yasası: Sabi sıcaklık ve basınçta gazların eşit hacimleri eşit sayıda molekül içerir. Yani belirtilen koşullarda gaz hacminin yarıya düşmesi gaz miktarının da yarıya düşmesi demektir. Avogadro yasası şu şekilde formulüze edilir: V1n2= V2n1= k4 Denklemdeki;- V1: Gazın ilk durumdaki hacmini
- V2: Gazın son durumdaki hacmini
- n1: Mol cinsinden gazın ilk durumdaki miktarını
- n2: Mol cinsinden gazın son durumdaki miktarını
- k4: Gazın basıncına ve sıcaklığına göre oluşturulan bir değişkeni temsil eder.
Normal Şartlar
Avogadro yasası sayesinde normal şartlar olarak adlandırılan (0°C ve 1 atm basınçta) koşullarında bulunan bir ideal gazın miktarını ve hacmini bilebiliriz. Normal şartlar altında bir mol gaz (6,02 x 1023 tane) 22.4 L hacim kaplar.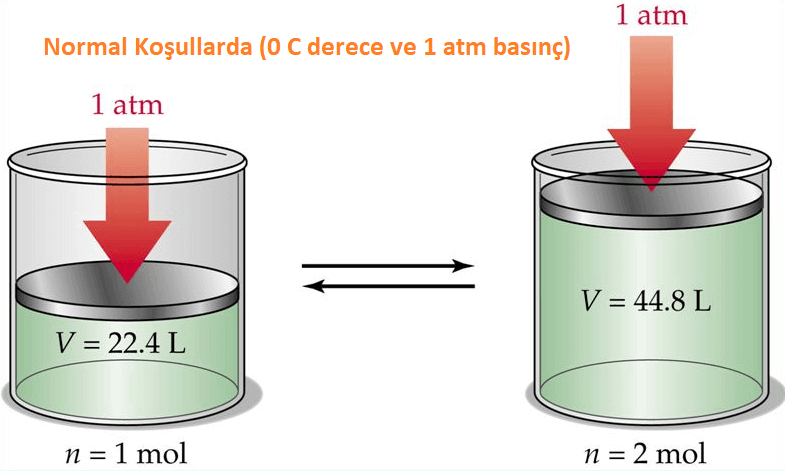
İdeal Gaz Denklemi
Gay-Lussac yasası, Boyle yasası ve Charles yasası, birlikte toplam gaz yasası’nı ortaya çıkarırlar. Bu yasaya bir de Avogadro yasası’nın eklenmesi, ideal gaz yasasını ortaya çıkarır. Gerçekte hiçbir gaz tamamen ideal gaz gibi davranmaz, çünkü bir gazın ideal gaz olarak kabul görmesi için aşağıdaki iki kabullenmeye uyması gerekir.
- Bir tek gaz molekülünün hacmi toplam hacmin yanında ihmal edilebilecek kadar küçüktür
- Moleküller arası çekim kuvveti yok denecek kadar azdır.
- P: İdeal gazın herhangi bir durumdaki basıncını (atm biriminden)
- V: İdeal gazın hacmini (litre cinsinden)
- n: İdeal gazın mol sayısını
- R: İdeal gaz sabitini
- T: İdeal gazın kelvin sıcaklığındaki değerini
İdeal Gaz Sabiti
İdeal gaz sabiti 0.082 (L.atm/mol.K) olarak alınır. Değerin bulunuşu normal şartlar altında yapılan hesaplamalardan gelir. Eğer basınç paskal cinsinden, hacim m³ cinsinden ve sıcaklık kelvin cinsinden alınırsa ideal gaz sabiti 8,31 (J/mol.K) olarak bulunur.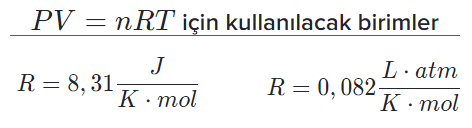
Sıvılar (Buhar Basıncı – Viskozite – Yüzey Gerilimi)
Sıvılar, maddenin temel hallerinden biridir. Sıvıyı oluşturan moleküller arasındaki çekim kuvveti, katılardan az, gazlardan ise fazladır. Bu özellik, sıvı moleküllerin birbiri üzerinde kayabilmesine ve akışkan olmalarına olanak tanır. Sıvılar, zamanla birbirleri içinde dağılır ve bulundukları kabın şeklini alırlar.Moleküller arası çekim kuvveti, sıvının oluşumunu sağlamanın yanı sıra başlıca buhar basıncı, viskozite ve yüzey gerilimi gibi birçok özelliği de belirler. Her biri sıvının farklı davranışlarını ve özelliklerini etkiler.
- Buhar Basıncı: Sıvının gaz fazına geçme eğilimini belirler. Sıvının yüzeyindeki moleküller, buhar basıncını oluşturur. Sıcaklık arttıkça buhar basıncı genellikle artar.
- Viskozite: Sıvının akışkanlığını ifade eden bir özelliktir. Bir sıvı ne kadar viskoz ise, akması o kadar zordur. Viskozite, moleküller arası sürtünmeye bağlıdır ve sıcaklık arttıkça genellikle azalır.
- Yüzey Gerilimi: Sıvının yüzeyindeki moleküller arasındaki çekim kuvvetini tanımlar. Yüzey gerilimi, sıvının bir damla olarak küresel bir şekil almasına ve belirli bir yüzey alanını kaplamasına neden olur. Bu özellik, sıvının yüzeyinde daha sağlam bir katman oluşturur.
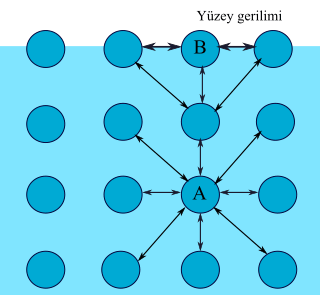
Yüzey Gerilimi
Yüzey gerilimi, sıvılarda gözlemlenen kohezyon özelliği sayesinde ortaya çıkar. Sıvının sınırında bulunan sıvı molekülleri iç kısımlardaki moleküller tarafından çekilir. Bu durum, çok sayıda molekülün sıvı içine gitmesini ve az sayıda molekülün yüzeyde kalmasını sağlar. Sonuç olarak, birbirine daha sağlam tutunan moleküller yüzeyde dirençli ve esnek bir katman oluşturur. Bu olaya yüzey gerilimi denir.
Havada bulunan bir su damlası, yüzey geriliminin etkisiyle küresel bir şekil alır. Yüzeysel gerilimin oluşturduğu etki, sıvıyı en düşük yüzey alanına sahip olacak şekilde düzenler; bu yapı da küresel bir şekil oluşturur. Yer çekiminin etkisiyle küresel şekil hafifçe düzleşebilir.
Kılcallık ile Yüzey Gerilimi Arasındaki İlişki
Kılcallık veya kapiler etki, sıvıların ince borularda yükselmesi veya alçalması olarak tanımlanır. Bu etki, sünger gibi maddelerin suyu emmesinde rol oynar. Silindirik bir boruda bir sıvının yükselme veya alçalma miktarı, sıvının yüzey gerilim katsayısı ile doğru orantılıdır; sıvının yoğunluğu, yer çekimi ivmesi ve borunun yarıçapı ile ters orantılıdır.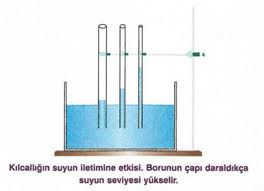
Kılcallık, adezyon ve kohezyon kuvvetleri sayesinde gerçekleşir.
- Adezyon: Benzer olmayan moleküller arasındaki çekim kuvvetlerine adhezyon kuvvetleri denir.
- Kohezyon: Benzer tanecikler arasındaki çekim kuvvetlerine kohezyon denir.
Sıvıların akmaya karşı gösterdiği dirence viskozite denir. Bir sıvının viskozitesi arttıkça madde daha yavaş akar. Örneğin; yağ, suya göre daha viskoz bir sıvıdır. Moleküller arası etkileşim arttıkça sıvının viskozite özelliği de artar.
Buhar Basıncı
Bir maddenin sıvı halden gaz hale geçmesine buharlaşma denir. Sıvılarda gerçekleşen buharlaşma, sıvı kaynar hale geldiğinde net bir şekilde gözlemlenebilir.
Dinamik Denge
Kapalı bir kap içine konulan sıvı, belirli bir sıcaklıkta buharlaşmaya başlar. Bu buharlaşma sırasında gaz taneciklerinin sayısı artar. Artan sayıdaki gaz tanecikleri çarpışarak kinetik enerjilerinin bir kısmını kaybeder ve sıvı hale dönerler (yoğuşma). Gaz tanecikleri sayısı belirli bir miktarı aştığında buharlaşma ve yoğuşma işlemleri aynı hızda gerçekleşmeye başlar, bu duruma “dinamik denge” denir. Sıvıyla dengede olan buhar halindeki moleküllerin belli bir sıcaklıkta yaptığı basınca sıvının buhar basıncı denir.
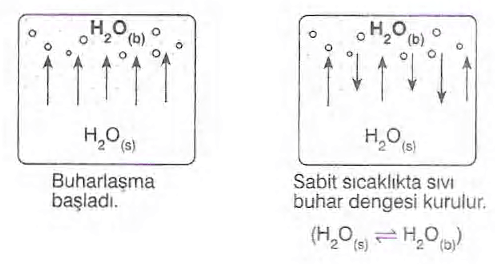
Sıvının sıcaklığı arttıkça buhar basıncı da artar. Buhar basıncı, çevredeki hava basıncına eşit olduğunda kaynama süreci başlar. Bu sıcaklığa da kaynama noktası denir. Kaynama sırasında sıvının sıcaklığı sabit kalır ve sıvı ne kadar çok ısı alırsa buharlaşma o kadar hızlı gerçekleşir. Bilimsel olarak kaynama noktaları, sıvının buhar basıncının 1 atm’e (760 mmHg) eşit olduğu sıcaklık olarak belirlenir ve buna “normal kaynama noktası” adı verilir.
Buhar basıncındaki artış, sıvının kaynama noktasını düşürür. Bu nedenle buhar basıncını etkileyen faktörler, sıvının cinsi ve saflığı gibi detaylar, kaynama noktasını etkiler. Örneğin, makarna yapılırken suya eklenen bir tatlı kaşığı tuz, suyun daha geç kaynamasına neden olarak yemeğin daha çabuk pişmesini sağlar.
Ayrıca, açık hava basıncı kaynama noktasını etkiler. Deniz seviyesinden yükseklik arttıkça açık hava basıncı azalır ve bu da kaynama noktasını düşürür. Bu durum, yüksek rakımda suyun daha düşük sıcaklıkta kaynamasına neden olur. Bu etkiyi aşmak için düdüklü tencereler geliştirilmiştir. Düdüklü tencereler, içlerindeki havayı tutarak tencerenin içindeki basıncı artırır. Bu sayede sıvı daha yüksek sıcaklıklarda kaynamaya başlar ve yemekler daha hızlı pişer.
Hal Değişimi
Hal değişimi, maddenin fiziksel özelliğinin değiştiği ancak kimyasal özelliğinin sabit kaldığı bir tür değişimdir. Bu değişim, moleküller arasındaki etkileşimlerin (zayıf etkileşimlerin) değişmesinden kaynaklanır.Örneğin, su katıdan sıvıya geçerken hidrojen bağlarının kuvveti zayıflar. Bu durumun tersine, su sıvıdan katıya geçerken hidrojen bağlarının kuvveti artar. Taneciklerin yapısında kimyasal bir değişim olmaması nedeniyle, hal değişimleri fiziksel değişimlere örnektir.
Hal değişimleri şu şekilde sınıflandırılabilir:
- Erime (Sıvı Haline Geçme): Katının sıcaklığı arttıkça moleküler düzeni bozularak sıvı hale geçer. Bu duruma erime denir. Erime noktası, katının sıvı hale geçtiği belirli bir sıcaklığı ifade eder.
- Donma (Katılaşma): Sıvının soğutulmasıyla moleküler düzen artar ve sıvı katı hale geçer. Bu olaya donma denir. Donma noktası, sıvının katı hale geçtiği belirli bir sıcaklığı ifade eder.
- Buharlaşma: Sıvının ısı alarak gaz hale geçme sürecidir. Buharlaşma genellikle sıcaklık arttıkça hızlanır.
- Yoğuşma: Gazın soğutularak sıvı hale geçmesidir. Yoğuşma genellikle sıcaklık azaldıkça gerçekleşir.
- Süblimleşme: Katının doğrudan gaz hale geçmesi olayına süblimleşme denir. Süblimleşme, katının buharlaşma noktasının altında bir sıcaklıkta oluşabilir.
| Eski Hal\Yeni Hal | Katı | Sıvı | Gaz |
| Katı | * | Erime | Süblimleşme |
| Sıvı | Donma | * | Buharlaşma |
| Gaz | Kırağlaşma | Yoğunlaşma | * |
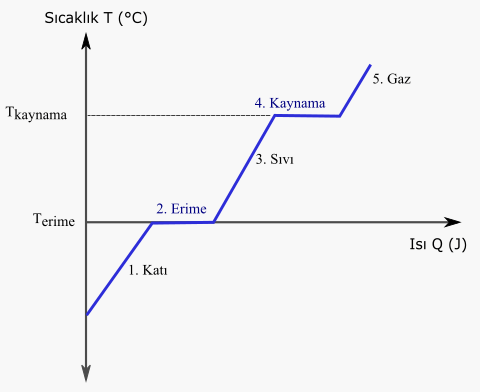
Katı – Sıvı Hal Değişimleri
Katı halde tanecikler sıkı bir yapıda bulunurken, sıvı veya gaz hallerinde moleküller arasındaki etkileşim daha gevşektir. Bu nedenle, katıların sıvı veya gaz haline geçebilmesi için ısı alması gereklidir.
Erime
Katının ısı alarak sıvı hale geçme sürecine erime denir. Erime olayının gerçekleştiği sıcaklığa erime noktası adı verilir. Saf bir maddenin sıvısının donma noktası ile katısının erime noktası genellikle aynıdır. Erime sırasında katı, ısı alarak sıvıya dönüşür ve bu süreç boyunca sıcaklık değişmez.
Donma
Sıvının ısı vererek katı hale dönmesine donma denir. Donma noktası, donma olayının gerçekleştiği sıcaklığı ifade eder. Saf bir maddenin sıvısının donma noktası ile katısının erime noktası genellikle aynıdır. Donma sırasında sıvı, ısı vererek katıya dönüşür ve bu süreç boyunca sıcaklık değişmez.
Sıvı – Gaz Hal Değişimleri
Sıvı molekülleri arasındaki etkileşim, katılardan daha zayıf olup gazlardan daha kuvvetlidir. Bu nedenle, sıvılar ısı alarak gaz, ısı vererek ise katı hale dönüşebilir.
Buharlaşma
Sıvıların ısı alarak gaz haline geçmesine buharlaşma denir. Buharlaşma, her sıcaklıkta gerçekleşebilir ve örneğin, 20 derecede asılan çamaşırların kuruması veya 40 derecede asılan çamaşırların kuruması gibi farklı sıcaklıklarda meydana gelebilir.
Yoğuşma
Gazın ısı vererek sıvı hale geçmesine yoğuşma denir. Yoğuşma, buharlaşmanın tam tersidir ve genellikle su döngüsü gibi doğal olaylarda görülür.
Katı – Gaz Hal Değişimleri
Süblimleşme
Bazı katılar, ısı aldıklarında sıvı hale geçmeden doğrudan gaz haline geçer. Bu olaya süblimleşme denir.
Kırağılaşma
Gaz haldeki bir madde, ısı vererek doğrudan katı hale geçtiğinde bu olaya kırağılaşma denir.
Katı Türleri
Maddeler, katı, sıvı, gaz ve plazma olmak üzere dört farklı halden birinde bulunabilirler. Maddeler arasında en düzenli yapıya sahip olanlar katılardır. Katı maddelerin kimyasal yapıları (atom, iyon veya moleküller) düzenli bir şekilde yerleşmiştir.Tüm maddeler, yeteri kadar soğutulduğunda katı hale geçer. Oluşan katıların özellikleri, katıyı oluşturan atom, iyon veya molekülleri bir arada tutan kuvvetlere bağlıdır.
Katıların yapısını incelediğimizde, görünüş ve özellik açısından farklı katı türlerinin bulunduğunu gözlemleriz. Bazı katılar serttir ve elektriği iyi iletir, bazıları ise yumuşak ve istenilen şekli alabilen katılardır; hatta bazıları elektriği iletemez. Katılar genellikle amor katılar ve kristal katılar olarak iki ana başlık altında incelenebilir.
Amorf Katılar
Amorf katıları oluşturan tanecikler, gelişi güzel ve düzensiz bir şekilde istiflenmiştir. Bu nedenle, amorf katıların belirli bir şekli yoktur. Cam, lastik, mumlar ve tereyağı gibi maddeler amorf katılara örnek olarak verilebilir. Bu katıların belirli bir erime veya donma noktası yoktur. Isıtıldıklarında belirli bir sıcaklıkta yumuşar ve akışkanlık kazanırlar. Bu yumuşama noktasına “camsı geçiş sıcaklığı” denir.
Kristal Katılar
Kristal katıları oluşturan tanecikler ise düzenli bir şekilde istiflenmiştir. Bu nedenle, kristal katıların belirli bir şekli vardır. Kristal katılar, iyonik, moleküler, kovalent ve metalik kristaller olmak üzere farklı sınıflara ayrılır. İyonik kristaller, iyonlardan oluşur ve iyonik bağlarla birbirlerine bağlıdır. Moleküler kristallerde moleküller arasındaki çekim kuvveti zayıftır. Kovalent kristallerde tanecikler arasında her doğrultuda kovalent bağlar bulunur. Metalik kristaller ise metallerin değerlik elektronlarının serbestçe hareket ettiği bir yapıya sahiptir ve metalik bağlarla birbirine bağlıdır.
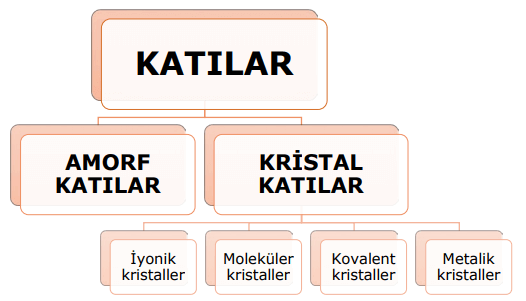
- Amorf Katılar:
Amorf katıları oluşturan tanecikler rastgele ve düzensiz bir şekilde yerleştirilmiştir. Bu nedenle, amorf katıların belirli bir şekli yoktur ve dış müdahale olmadan doğal bir biçimleri oluşmaz. Cam, lastik, mumlar, ve tereyağı gibi maddeler bu kategoriye örnek olarak verilebilir. Amorf katıların belirli bir erime veya donma noktası yoktur. Isıtıldıklarında belirli bir sıcaklıkta yumuşarlar ve akışkanlık kazanırlar, bu şekilde şekillendirilebilirler. Amorf katının yumuşamaya başladığı sıcaklığa “camsı geçiş sıcaklığı” denir. - Kristal Katılar:
Kristal katıları oluşturan tanecikler düzenli bir şekilde yerleştirilmiştir. Bu düzen, kristal katılara belirli bir şekil ve yapı kazandırır. Kristal katıların belirli bir erime ve donma noktası vardır. Yüzeyleri genellikle düzdür ve geometrik şekillerden oluşur. Altın, sodyum klorür ve elmas gibi maddeler kristal yapılı katılara örnektir. Kristal katılar iyonik, moleküler, kovalent ve metalik kristaller olmak üzere dört farklı sınıfa ayrılır.a) İyonik Kristaller:
İyonik kristalleri oluşturan tanecikler iyonlardır ve aralarında iyonik bağlar bulunur. Bu bağlar kuvvetli olduğundan, iyonik kristallerin erime noktaları yüksektir. Ancak, katı haldeki iyonlar serbestçe hareket edemedikleri için elektrik akımını iletemezler.b) Moleküler Kristaller:
Şeker veya buz gibi maddeler moleküler kristallere örnektir. Moleküler kristallerde, moleküller arasındaki çekim kuvveti iyonik ve kovalent bağlara oranla daha zayıftır, bu nedenle erime ve kaynama noktaları düşüktür.c) Kovalent Kristaller:
Kovalent kristallerde tanecikler arasında her yönde kovalent bağlar bulunur. Bu kristallerin erime noktaları çok yüksektir ve oldukça sertlerdir.d) Metalik Kristaller:
Metalik kristallerde, metallerin değerlik elektronları komşu metal atomlarının boş değerlik orbitallerine geçebilir. Oluşan elektron denizi içinde (+) yüklü metal iyonları meydana gelir. Metalik kristaller değerlik elektron sayısına bağlı olarak farklı erime ve kaynama noktalarına sahiptir, elektrik akımını iyi iletirler ve parlak bir yüzeye sahiptirler.


